卵巣は、子宮の左右にある親指大の楕円形の器官です。卵巣には、女性ホルモンを合成・分泌し、卵子を生成、成熟、排卵する機能があります。
卵巣がんは、卵巣に発生したがんです。卵巣がんが進行すると、腹膜の表面に腫瘍細胞が散布され、生着した状態である腹膜播種(ふくまくはしゅ)が生じやすくなります。また、胃から垂れ下がり小腸や大腸を覆っている大網(たいもう、だいもう)、後腹膜リンパ節、大腸、小腸、横隔膜、脾臓等に転移することがあります。
卵巣の腫瘍は、上皮性腫瘍、胚細胞性腫瘍、性索間質性腫瘍に分けられますが、最も多いのは卵巣の表層を覆う細胞に由来する上皮性腫瘍です。上皮性卵巣がんは、卵巣がんの約90%を占めます。
上皮性のがんは、主に漿液性がん、粘液性がん、類内膜がん、明細胞がんという4つの組織型に分けることが出来、それぞれ異なった性質を持っています。
目次
卵巣がんのリスクファクター
初潮年齢が早いこと、妊娠歴がないこと、閉経年齢が遅いこと、排卵誘発剤を使用していることなどが卵巣がんを発症するリスクを高めると言われています。
また、上皮性卵巣がんの10%は家族性であり、大部分がBRCA1遺伝子またはBRCA2遺伝子の変異に起因します。
卵巣がんに関係する遺伝子
下の表は、316人の進行性漿液性卵巣がんの患者様のサンプルにおいて有意に変異が見られた遺伝子とそのサンプル数を示しています。
遺伝子の本体であるDNAの修復や細胞増殖の停止、細胞ががん化したときアポトーシス(プログラムされた細胞死)を起こさせる、がん抑制遺伝子の一つであるTP53(p53)遺伝子には95%以上のサンプルで変異が見られました。
遺伝性乳がん・卵巣がん症候群(HBOC:Hereditary Breast and Ovarian Cancer)の原因となるがん抑制遺伝子であるBRCA1遺伝子とBRCA2遺伝子には、生殖細胞系列変異(生まれついての変異)や体細胞変異(環境、生活習慣、加齢等の影響による変異)が見られました。
| 遺伝子 | 変異が見られたサンプル数 |
| TP53 | 302 |
| BRCA1 | 11 |
| CSMD3 | 19 |
| NF1 | 13 |
| CDK12 | 9 |
| FAT3 | 19 |
| GABRA6 | 6 |
| BRCA2 | 10 |
| RB1 | 6 |
下の図は、489人の進行性漿液性卵巣がんにおいて、遺伝子が存在する染色体で増幅された部分を赤で、欠失した部分を青で示したものです。上から下にかけて1番から22番までの常染色体を白または薄い灰色の背景で示しており、増幅の比率が高ければ左から右方向に赤線が延びており、欠失の比率が高ければ右から左方向に青線が延びています。
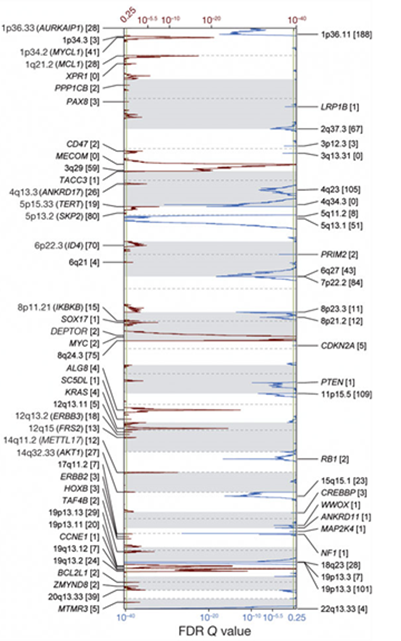
最も高頻度に増幅された遺伝子はCCNE1、MYC、MECOMで、20%以上の患者様の進行性漿液性卵巣がん組織において増幅されていました。
一方、がん抑制遺伝子であるPTEN、RB1、NF1は、2%以上の患者様において、父方および母方から受け継いだ一対の染色体のどちらも欠失していました。
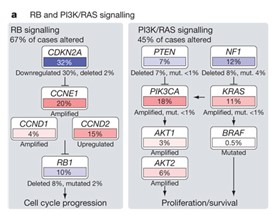
上の図は、316人の進行性漿液性卵巣がんの患者様のがんサンプルについて、遺伝子変異、遺伝子増幅、遺伝子発現を調べた結果から明らかになった2つの主な細胞内情報伝達(シグナリング)経路の亢進を表したものです。
左側のRBシグナリング経路は、細胞周期(細胞分裂に至る細胞内に起こる一連の変化)を進め細胞分裂を促進する経路です。それぞれの四角の中の上側に遺伝子名、下側にその遺伝子発現が抑制または促進されたか、欠失または増幅したか、変異したかを、遺伝子の働きが活性化した場合は赤色で、不活化した場合は青色で、その程度を色の濃さで表しています。また、それぞれの遺伝子が発現したタンパク質の相互作用について、一方が他方の機能を促進する場合は→で、抑制する場合は⊥で表しています。
全体としてみると、RBシグナリング経路は、67%のサンプルで変化していました。RBシグナリング経路の上流では、がん抑制遺伝子であるCDKN2A(p16)の発現が抑制または遺伝子そのものが欠失し、下流ではまた別のがん抑制遺伝子であるRB1遺伝子が欠失したり変異したりすることによって機能低下したことにより、がん細胞の細胞分裂が促進されていました。
右側のPI3K/RASシグナリング経路は、細胞の増殖や生存に関わる経路です。全体としてみると、このシグナリング経路は45%のサンプルで変化していました。上流ではがん抑制遺伝子であるPTEN遺伝子やNF1遺伝子が欠失したり変異したりし、下流ではAKT1/2遺伝子やKRAS遺伝子、BRAF遺伝子が増幅したり活性化変異したりすることにより、がん細胞の増殖や生存が促進されていました。
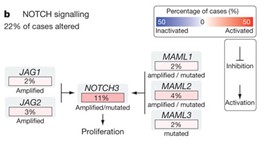
上の図は、タンパク質間の相互作用のネットワークの解析により明らかになったシグナリング経路です。NOTCHシグナリング経路は、多くのがんにおいて乱れていることが知られていますが、進行性漿液性卵巣がんの患者様では22%のがんサンプルで変化が見られました。このシグナリング経路の下流では、NOTCH3遺伝子が増幅または活性化変異することにより細胞増殖が促進されていました。
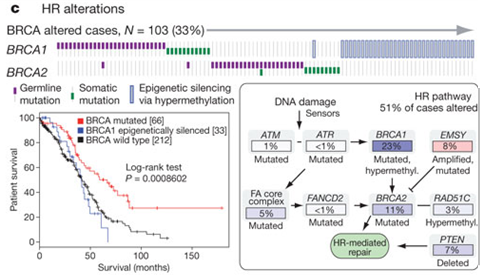
DNAが変異したり、メチル化したりしたBRCA1遺伝子や、DNAが変異したBRCA遺伝子の存在は、DNA2本鎖の切断を修復する機構である相同組み換えを阻害することが知られていますが、進行性漿液性卵巣がんの患者様では、33%のサンプルでこのようなBRCA遺伝子の異常が生じていました。
上の図の上段では、BRCA1遺伝子、BRCA2遺伝子について、生まれながらの変異である生殖細胞系列の変異を紫色で、環境や生活習慣による変異である体細胞変異を緑色、DNAのメチル化による遺伝子発現低下を縦長の長方形で各患者様の結果を左から右に並べて示しています。その結果、BRCA1遺伝子の生殖細胞系列の変異、体細胞変異、BRCA2遺伝子の生殖細胞系列の変異、体細胞変異、BRCA1遺伝子のメチル化は基本的に相互に排他的であることが分かりました。
また、上の図の左下の生存曲線が示すように、BRCA遺伝子に変異があった患者様の方が、BRCA遺伝子に変異がなかった患者様やBRCA1遺伝子がメチル化して発現が低下した患者様より予後が良いことが分かりました。
進行した卵巣がんの分子標的薬であるオラパリブ(リムパーザ)は、DNA1本鎖の修復に関係するPARP(ポリADP-リボースポリメラーゼ)の阻害剤ですが、BRCA1やBRCA2遺伝子に変異をもつ卵巣がんの治療に用いられます。これは、本来、DNA1本鎖の修復に関係するPARPが機能しなければDNA2本鎖が切断し BRCA1/2が相同組み換えにより修復するはずですが、BRCA1やBRCA2遺伝子に変異等あればPARPを阻害することによりDNAの切断の修復が出来なくなりがん細胞の細胞死を誘導することが出来るからです(4)。
この研究における進行性漿液性卵巣がんの解析から、上の図の右下にまとめたようにBRCA1/2遺伝子以外にもDNA2本鎖切断時の相同組み換えによる修復に関わる遺伝子の変異、増幅、欠失が明らかになり、BRCA1/2遺伝子の変異等を含めて51%のサンプルでDNA2本鎖切断時の相同組み換えによる修復機構の抑制が生じていました。これら、DNA2本鎖切断時の相同組み換えによる修復に関わる遺伝子の変異、増幅、欠失の存在は、オラパリブ(リムパーザ)の新たな適応可能性を調べる根拠となるものです(5、6)。
1.国立がん研究センターがん情報サービス>病名から探す>卵巣がん>卵巣がんについて
https://ganjoho.jp/public/cancer/ovary/about.html
2.国立がん研究センター内科レジデント編、がん診療レジデントマニュアル、第8版、医学書院、2019年。
3.Cancer Genome Atlas Research Network. Integrated Genomic Analysis of Ovarian Carcinoma. Nature 2011; 474: 609-15. doi: 10.1038/nature10166.
https://www.nature.com/articles/nature10166
4.日本産婦人科医会 ホーム>産婦人科ゼミナール>Dr.Koba>子宮内膜症の癌化を見逃さない臨床的なポイント>11. PARP阻害薬による新規卵巣癌治療 ―PARP阻害薬の作用機序―
https://www.jaog.or.jp/lecture/11-parp%E9%98%BB%E5%AE%B3%E8%96%AC%E3%81%AB%E3%82%88%E3%82%8B%E6%96%B0%E8%A6%8F%E5%8D%B5%E5%B7%A3%E7%99%8C%E6%B2%BB%E7%99%82/
5.Nidhi Goel, McKenzie E Foxall, Carly Bess Scalise, Jaclyn A Wall, Rebecca C Arend. Strategies in Overcoming Homologous Recombination Proficiency and PARP Inhibitor Resistance. 2021, Mol. Cancer Ther. 20:1542-1549. doi: 10.1158/1535-7163.MCT-20-0992.
https://mct.aacrjournals.org/content/20/9/1542.article-info
6.Xuan-Zhang Huang, Han Jia, Qiong Xiao, Run-Zhou Li, Xing-Shuang Wang, Hai-Yan Yin, Xin Zhou. Efficacy and Prognostic Factors for PARP Inhibitors in Patients with Ovarian Cancer. 2020. Front. Oncol. 10:958. doi: 10.3389/fonc.2020.00958.
https://www.frontiersin.org/articles/10.3389/fonc.2020.00958/full
参照日:2021年10月