膀胱がんは、膀胱に出来るがんです。膀胱は腎臓で作られ尿管を通って来た尿を一時的に貯める働きをし、尿はある程度の量になったら尿道を通して体外に排出されます。膀胱がんの大部分は膀胱の内部を覆う尿路上皮という粘膜に出来る尿路上皮がんです。
尿路上皮がんは、筋層に浸潤しているかどうかにより、筋層非浸潤性がんと筋層浸潤性がんとに分けられます。膀胱がんには、尿路上皮がんの他に扁平上皮がん、腺がん、小細胞がんなどの種類があります。
目次
膀胱がんのリスクファクター
喫煙者は非喫煙者に比較して2倍から5倍尿路上皮がんの発症リスクがあるとされています。また、ナフチルアミンの職業性暴露、シクロフォスファミドやフェナセチンを含む鎮痛薬について報告があります。
膀胱がんに関係する遺伝子
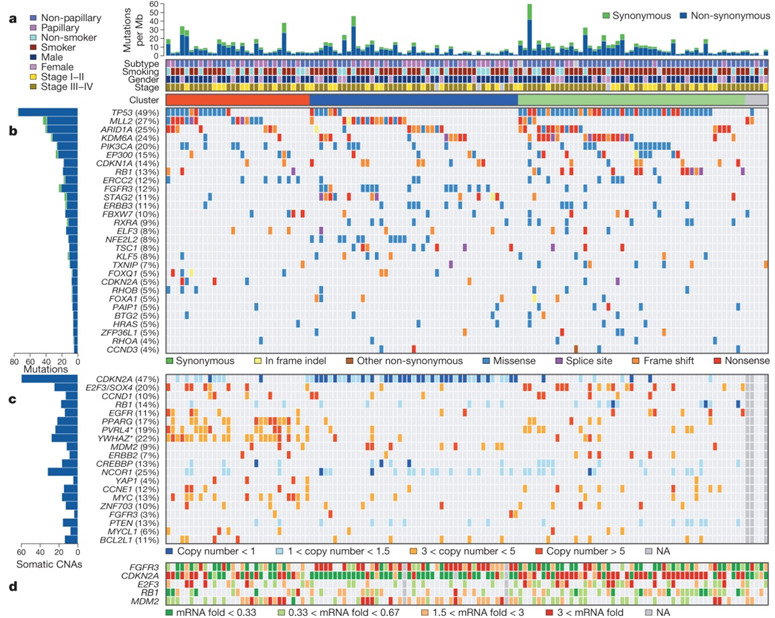
以下では、131人の筋層浸潤性尿路上皮膀胱がんの患者様の解析結果を示します。下図のaの上段のヒストグラムでは、それぞれの患者様のDNAにどの程度変異があったかを比率で示しています。変異の内、緑色はDNAから転写・翻訳されたタンパク質のアミノ酸が変化しない変異(Synonymous mutation)、青色はアミノ酸が変化するDNAの変異(Non-synonymous mutation)を示しています。一般的にタンパク質のアミノ酸が変化するDNAの変異が多いことが分かります。
aの下段では、上から順に組織型(Subtype; 非乳頭状(青色)、乳頭状(紫色))、喫煙者か否か(Smoking;非喫煙者(水色)、喫煙者(オレンジ色))、性別(Gender; 男(濃い青色)、女(紫色))、ステージ(Stage; I、II(黄色)、III、IV(黄土色))を示しています。
aとbとの間には、解析された膀胱がんを3つのグループに分けた結果を示しています。左側のオレンジ色で示したグループでは、cに示すように多くの遺伝子で増幅が起こっていました。次の青色で示したグループでは、cの最上段に示すようにCDKN2A(p16)というがん抑制遺伝子の欠失が多く見られました。右側の黄緑色のグループでは、bに示すように多くの患者様でがん抑制遺伝子であるTP53(p53)やRB1に変異が見られました。
bでは、統計学的に有意に変異している遺伝子を頻度の高い順に上から下に並べ、右にはそれぞれの患者様について変異のタイプを示しています。代表的ながん抑制遺伝子であるTP53(p53)が最も多くの患者様(49%)で変異していました。TP53(p53)に変異が見られない患者様ではTP53(p53)を抑制するMDM2の遺伝子が増幅し発現が増加している例が多くみられました。これらを合わせると76%の患者様でTP53(p53)の機能が不活化していることが分かりました。
変異のタイプで主なものは、タンパク質のアミノ酸が置き換わる変異(Missense、青色)、DNAの読み枠が変化することによりタンパク質のアミノ酸配列が変わってしまう変異(Frame shift、オレンジ色)、タンパク質の合成が途中で止まってしまう変異(Nonsense、赤色)でした。
cでは、多くの患者様で欠失や増幅が見られた遺伝子を示しています。左端に遺伝子名を示し、その右側にそれぞれの患者様でその遺伝子がどの程度欠失または増幅しているか(1より少ない:濃い青、1から1.5:薄い青、正常では母親と父親から1つずつ合計2つ遺伝子を持っています、3から5:薄いオレンジ色、5より多い:濃いオレンジ色)を示しています。CDKN2A(p16)というがん抑制遺伝子は、47%の患者様で欠失が見られることが分かりました。
dでは、膀胱がん組織においてDNAから転写されたメッセンジャーRNA(mRNA)が平均的な発現量から何倍少ないか多いか(0.33倍より少ない:濃い緑色、0.33から0.67倍:薄い緑色、1.5から3倍:薄いオレンジ色、3倍より多い:濃いオレンジ色)を示しています。CDKN2A(p16)というがん抑制遺伝子では、DNAにおける遺伝子の欠失が見られた患者様ではDNAから転写されるメッセンジャーRNA(mRNA)の発現量も少ないことが分かりました。
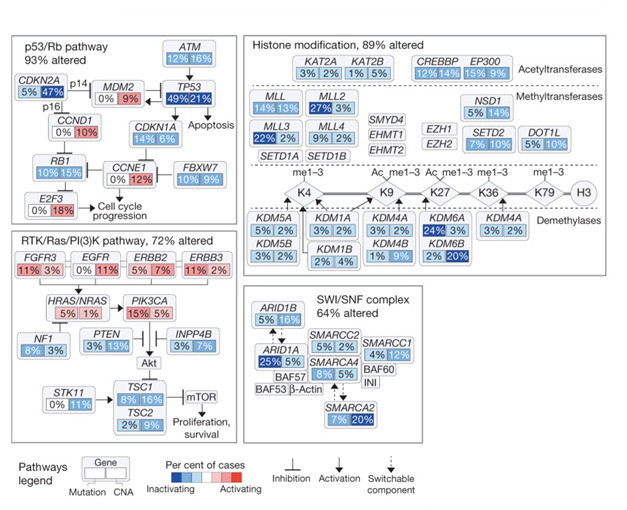
以上のように膀胱がんで変異している遺伝子や増幅または欠失した遺伝子を統合的に解析すると、以下の3つの細胞内シグナリング経路の不全が高頻度に見られることが分かりました。
1つ目は下図の左上にまとめた細胞分裂周期を調節するp53/Rb経路の亢進です。この経路は93%の患者様で変化していました。この経路に関係する各遺伝子の左下にはその遺伝子が変異した患者様の割合、右下には遺伝子の欠失または増幅が見られた患者様の割合を示しています。
青色はその遺伝子の機能を不活化させる変異や欠失の程度を色の濃さで表し、赤色はその遺伝子の機能を活性化させる変異や増幅の程度を色の濃さで表しています。→(促進)や⏊(抑制)は遺伝子間の相互作用を表します。がん抑制遺伝子であるCDKN2A(p16)、TP53(p53)、RB1の不活化が細胞分裂の促進につながっていることが分かります。
下図の左下のRTK/Ras/PI(3)K経路は72%の患者様で変化していました。この経路が活性化されるとがん細胞の増殖や生存が高まります。この経路を活性化する受容体チロシンキナーゼであるFGFR3、EGFR、ERBB2、ERBB3の活性化、がん抑制遺伝子であるPTENの不活化がこの経路を活性化することによりがん細胞の増殖や生存を高めていることが分かります。
下図の右では、遺伝子の転写を調節するヒストンタンパク質やSWI/SNF複合体を制御する遺伝子がそれぞれ89%と64%の患者様で変化していることを示しています。
下図のaでは、左側にPI(3)K/AKT/mTOR経路を構成する遺伝子を示し、その右側に各患者様におけるその遺伝子の変化の様式を示しています。
緑色の小さな四角は遺伝子の変異(Recurrent mutation)を、赤色の長方形の枠はメッセンジャーRNA(mRNA)の過剰発現(mRNA overexpression)、黒い小さな四角はタンパク質が短くなる遺伝子変異(Truncating mutation)、青色の長方形は母親および父親から受け継いだ2つの遺伝子をどちらも欠失したこと(Homozygous deletion)を示しています。
これによると、この経路を構成する遺伝子であるPIK3CA、AKT3、TSC1、PIK3R1、PTEN、TSC2における変化は各患者様について基本的に相互に排他的であることが分かります。すなわち、この経路に関わる遺伝子一つの変化がこの経路を活性化しがん細胞の増殖を促進する可能性があることを示しています。
下図のbでは、左側にRTK/RAS経路を構成する遺伝子を示し、その右側に各患者様におけるその遺伝子の変化の様式を示しています。黒い小さな四角はタンパク質が短くなる遺伝子変異(Truncating mutation)、赤色の長方形は遺伝子の増幅(Amplification)、黒い三角は遺伝子融合(Fusion)、緑色の小さな四角は遺伝子の変異(Recurrent mutation)を示しています。これによると、この経路を構成する遺伝子であるFGFR3、ERBB2、EGFR、ERBB3、NF1、HRAS、NRASにおける変化についても各患者様について基本的に相互に排他的であることが分かります。すなわち、この経路に関わる遺伝子一つの変化がこの経路を活性化しがん細胞の増殖を促進する可能性があることを示しています。
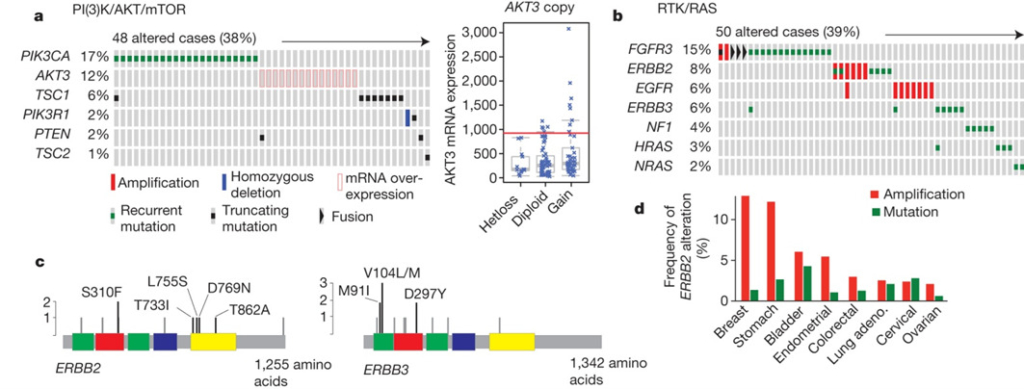
上図のcでは、受容体チロシンキナーゼであるERBB2とERBB3遺伝子の変異がそれぞれのタンパク質のどのアミノ酸を変化させることが多いかを示しています。このような情報が、ERBB2やERBB3を抑制する薬剤の設計に重要となります。
上図のdでは、がんを増殖させる働きのあるERBB2遺伝子の増幅や変異が膀胱がんその他のがん種でどの程度起こっているかを示しています。乳がん(Breast)、胃がん(Stomach)、膀胱がん(Bladder)、子宮内膜がん(Endometrial)、結腸直腸がん(Colorectal)、肺腺がん(Lung adeno.)、子宮頸がん(Cervical)、卵巣がん(Ovarian)においてERBB2遺伝子が変化していましたが、膀胱がんでは、乳がん、胃がんに次いで3番目にERBB2遺伝子の増幅が高頻度で見られ、遺伝子変異は最も高頻度で見られることが分かりました。
1.国立がん研究センターがん情報サービス>病名から探す>病名から探す>膀胱がん
https://ganjoho.jp/public/cancer/bladder/index.html
2.国立がん研究センター内科レジデント編、がん診療レジデントマニュアル、第8版、医学書院、2019年。
3.The Cancer Genome Atlas Research Network. Comprehensive molecular characterization of urothelial bladder carcinoma. Nature 507: 315–322 (2014).
https://www.nature.com/articles/nature12965
参照日:2022年1月24日