目次
前立腺がんとは
前立腺は、尿道のまわりを取り囲んでいる栗の実のような形をした男性にのみある臓器です。前立腺は、精液の一部である前立腺液を作りますが、前立腺液にはPSAというタンパク質が含まれています。前立腺がんは、前立腺の細胞が無秩序に増殖することにより発生し、リンパ節と骨に転移することが多いですが、肝臓や肺にも転移することがあります。
前立腺がんのリスクファクター
加齢、高脂肪食、喫煙などが前立腺がんになるリスクを高めるものと考えられています。
前立腺がんに関係する遺伝子
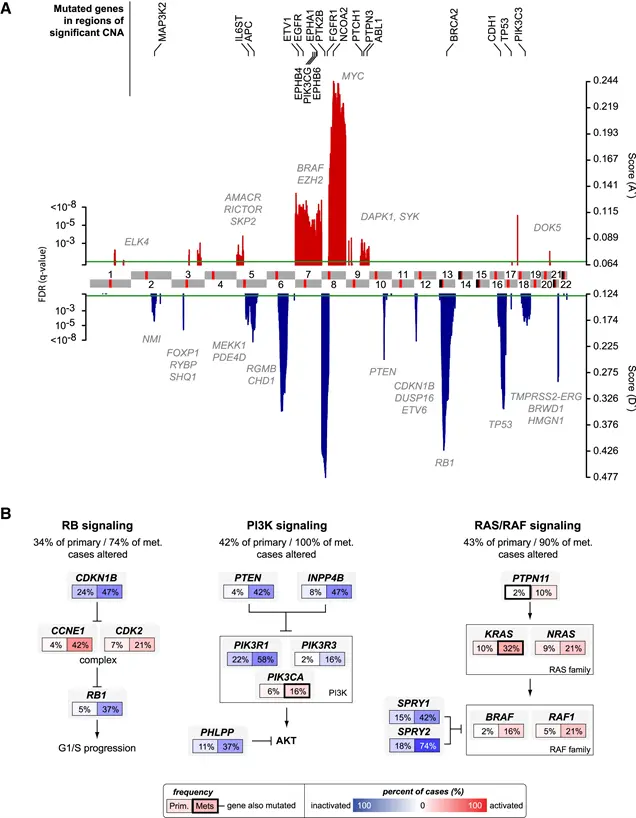
上の図は、218人の前立腺がんの原発腫瘍または転移腫瘍に生じていた遺伝子の異常をまとめたものです(2)。A図では、遺伝子の本体であるDNAが畳み込まれている染色体を左から右に番号順に並べ、遺伝子増幅を上方へ向かうヒストグラム(赤)で遺伝子欠失を下方へ向かうヒストグラム(青)で表したものです。様々な遺伝子が増幅したり欠失したりしていることが分かりますが、がんの発生に重要な遺伝子の異常として、17番染色体にあり細胞ががん化したときアポトーシス(プログラムされた細胞死)を起こさせるTP53(p53)遺伝子や10番染色体にある別のタイプのがん抑制遺伝子であるPTEN遺伝子が欠失することが高頻度で見られることが分かりました。
B図では、遺伝子の増幅や欠失、遺伝子発現、遺伝子変異のデータを総合し、前立腺がん細胞ではどのような細胞内シグナル伝達経路に不活化(青)や活性化(赤)が起こっているかを調べました。その結果、細胞増殖を抑制することによって細胞のがん化を抑制する経路であるRB signalingの不活化(原発腫瘍の34%、転移腫瘍の74%)、細胞周期の調節に重要な細胞内シグナル伝達経路であるPI3K signalingの活性化(原発腫瘍の42%、転移腫瘍の100%)、受容体チロシンキナーゼシグナル伝達経路であるRAS/RAFシグナル伝達経路の活性化(原発腫瘍の43%、転移腫瘍の90%)が見られました。それぞれの遺伝子の名前の下の四角の左側は原発腫瘍における不活化または活性化の割合、右側は転移腫瘍における不活化または活性化の割合を不活化または活性化の程度を青色または赤色の濃さで示しています。
前立腺がんの進行には男性ホルモンが関与しているため、内分泌療法により男性ホルモンの分泌や作用を抑えることにより前立腺がんの進行を抑制する治療が行われます(ホルモン療法)。しかし、ホルモン療法を続けているうちに、男性ホルモンの分泌や作用が抑えられているのに前立腺がんが進行してしまう場合があり、このような状態の前立腺がんのことを去勢抵抗性前立腺がん(castration-resistant prostate cancer: CRPC)といいます。以下の研究では、転移性の去勢抵抗性前立腺がんの患者様の転移した前立腺がんの組織を用いて前立腺がんに関係する遺伝子を調べました(3)。
150人の転移性去勢抵抗性前立腺がんの患者様の前立腺がんが転移したリンパ節、骨、肝臓、軟部組織の内1つの組織を用いて、遺伝子解析を行いました。下の図は、そのような転移した前立腺がん組織における遺伝子の異常をまとめたものです。
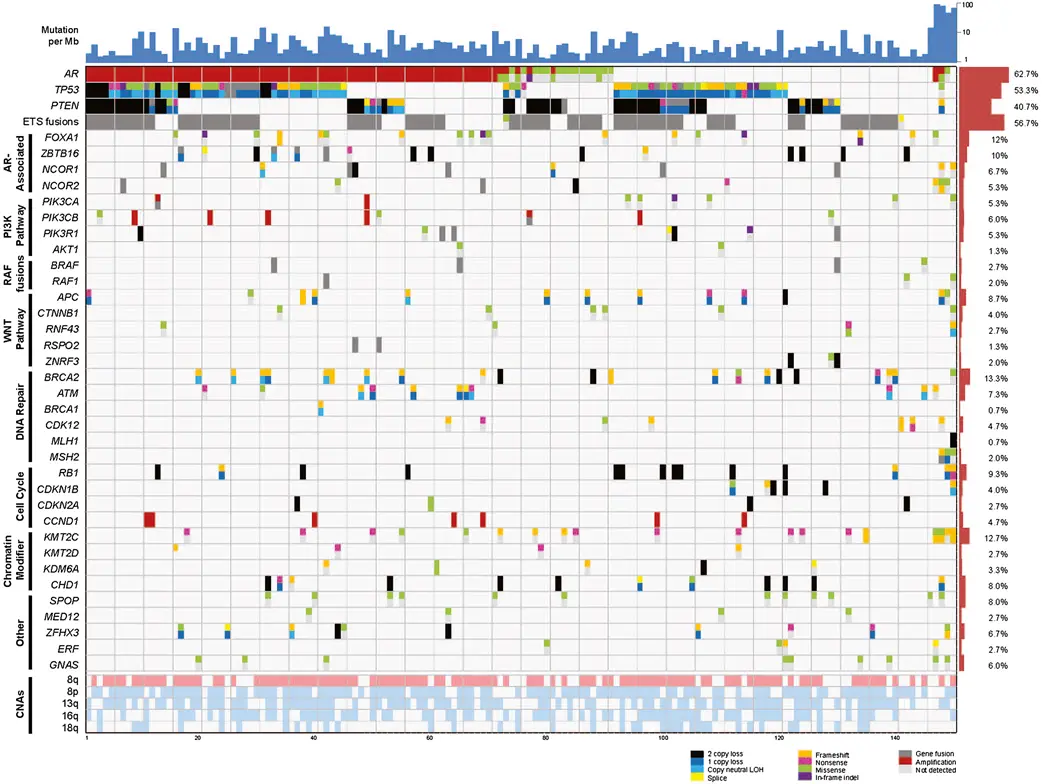
左右にそれぞれの患者様を配置し、上下に様々な遺伝子の状態を示しています。最上段の青色のヒストグラムは、それぞれの患者様の遺伝子の本体であるDNAにおける塩基(アデニン、グアニン、シトシン、チミン)について100万塩基対当たりどの程度変異があったかを示しています。
右側の横方向のヒストグラムは、それぞれの遺伝子について異常が見られる患者様の割合を示しています。上からAR(アンドロゲン受容体)、TP53(p53)、PTENの3つの遺伝子に異常が見られる患者様が多いことが分かります(62.7%、53.3%、40.7%)。また、56.7%の患者様には、ERG遺伝子とTMPRSS2遺伝子が融合したETS fusions(融合)が見られました。
FOXA1からGNAS遺伝子までは、その遺伝子産物の働きごとにグループ分けされています。AR-Associatedは、男性ホルモンが作用するアンドロゲン受容体の働きに関係する遺伝子のグループです。PI3K Pathwayは、ホスファチジルイノシトール3-キナーゼ(PI3K)が細胞膜の構成成分であるイノシトールリン脂質をリン酸化する経路で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化します。RAF fusionsは、タンパク質をリン酸化する酵素であるRAFタンパク質の遺伝子の融合が起こっている場合です。WNT pathwayは、分泌性糖タンパク質であるWnt が細胞膜受容体に結合することにより様々な細胞内シグナル経路を活性化する経路です。DNA repairは、DNA修復に関わる遺伝子のグループです。Cell cycleとは、細胞周期に関わる遺伝子のグループです。Chromatin modifierは、DNAとタンパク質の複合体であるクロマチンの修飾に関わる遺伝子のグループです。
最下段のCNAsには、遺伝子の本体であるDNAが折りたたまれた染色体の番号と部位(短腕p、長腕q)において増幅(ピンク)や欠失(薄い青)が多く見られる場合を示しています。
遺伝子異常のタイプは色分けされており、黒の2 copy lossとは両親から1つずつ受け継いだ遺伝子を2つとも欠失した場合、濃い青の1 copy lossとは片方だけ欠失した場合、青のCopy neutral LOHとは対立遺伝子の一方に異常が元々あり、もう一方の遺伝子にも異常が生ずる場合です。
黄色のSpliceとは、遺伝子の塩基配列がタンパク質のアミノ酸配列に翻訳される前の過程で遺伝子の異なる部分の塩基配列がアミノ酸に翻訳され部分的に異なるタンパク質が出来る可能性のある変異ことです。
オレンジ色のFrameshiftとは遺伝子の塩基配列の読み枠が変化し異なるアミノ酸配列のタンパク質が出来ることです。
濃いピンク色のNonsenseとは遺伝子の塩基配列のタンパク質のアミノ酸への翻訳が途中で止まる変異です。
Missenseとは遺伝子の塩基配列の変異によりタンパク質に異なったアミノ酸が組み込まれることです。In-frame indelとは遺伝子の塩基の挿入や欠失によりタンパク質に異なったアミノ酸が組み込まれたり欠失したりするが、遺伝子の塩基配列の読み枠は変化しないことです。灰色のGene fusionとは遺伝子が途中で他の遺伝子と融合することです。えんじ色のAmplificationとは遺伝子が増幅することです。
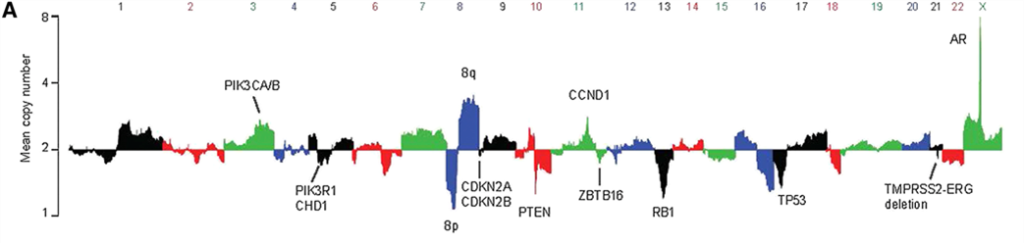
上の図は、各染色体を左から右へ番号順に並べ、遺伝子の重複があれば上方向に向かい、遺伝子の欠失があれば下方向に向かう連続した線で示したものです。隣り合った染色体は異なる色で区別しています。また、それぞれの染色体部分に存在する重複または欠失する代表的な遺伝子の位置を示しています。
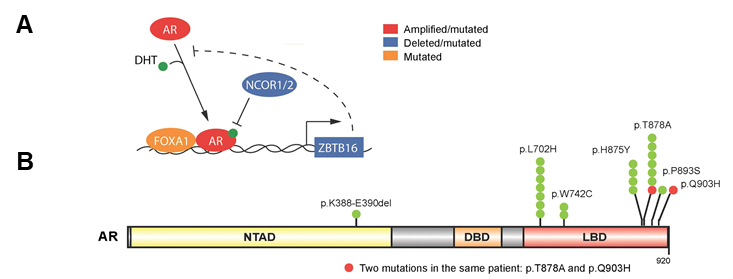
上のA図では、男性ホルモン(DHT)が作用するアンドロゲン受容体(AR)とアンドロゲン受容体の働きに関係するタンパク質(FOXA1、NCOR1/2、ZBTB16)がどのように相互作用するのかを示しています。アンドロゲン受容体(AR)に男性ホルモン(DHT)が結合すると2重の波線で示したDNAに結合し様々な遺伝子の転写(発現)を促進しますが、転写因子であるFOXA1タンパク質はアンドロゲン受容体(AR)の働きを補助します。
一方、NCOR1/2タンパク質はアンドロゲン受容体(AR)の働きを抑制します。アンドロゲン受容体(AR)により転写され発現したZBTB16タンパク質もアンドロゲン受容体(AR)の働きを抑制します。去勢抵抗性前立腺がんの患者様では、アンドロゲン受容体(AR)遺伝子は増幅したり変異したりし、FOXA1遺伝子は変異し、NCOR1/2やZBTB16遺伝子は欠失したり変異したりすることにより、男性ホルモンの分泌や作用を抑えても前立腺がんが進行してしまうと考えられます。
上のB図はアンドロゲン受容体(AR)遺伝子のどのような部分に変異が多く見られるかを示しています。これによるとアンドロゲン受容体(AR)において男性ホルモン(DHT)と結合する部分(LBD)に多く変異が見られることが分かります。これも去勢抵抗性前立腺がんの患者様においては、男性ホルモンの分泌や作用を抑えても前立腺がんが進行してしまう理由と考えられます。
1.国立がん研究センター がん情報サービス>病名から探す>前立腺がんhttps://ganjoho.jp/public/cancer/prostate/index.html
2.Barry S Taylor et al., Integrative genomic profiling of human prostate cancer. Cancer Cell 2010; 18: 11-22. doi: 10.1016/j.ccr.2010.05.026. https://www.cell.com/cancer-cell/fulltext/S1535-6108(10)00238-2
3.Dan Robinson et al., Integrative clinical genomics of advanced prostate cancer. Cell 2015; 161: 1215-1228. doi: 10.1016/j.cell.2015.05.001. https://www.cell.com/cell/fulltext/S0092-8674(15)00548-6?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867415005486%3Fshowall%3Dtrue
参照:2021年09月02日