目次
遺伝子治療とは
厚生労働省が定めた「遺伝子治療等臨床研究に関する指針」において、「遺伝子治療」とは「疾病の治療や予防を目的として遺伝子または遺伝子を導入した細胞を人の体内に投与することをいう」と定義されています。
参考(外部ページ):厚生労働省 遺伝子治療等臨床研究に関する指針
この指針にも明記されているように、遺伝子治療において治療用遺伝子を体内に導入する方法には、2つあります。
in vivo遺伝子治療
治療用遺伝子をヒトの体内に直接投与する方法。
ex vivo遺伝子治療
一旦ヒトの細胞や臓器を体外に取り出した上で治療用遺伝子を導入しその細胞や臓器を体内に戻す方法。
2012年にノーベル生理学・医学賞を受賞した山中伸弥教授らが開発した人工多能性幹細胞(iPS細胞)はex vivo遺伝子治療の一種です。
遺伝子の運び屋(ベクター)とは
特にin vivo遺伝子治療においては、治療用遺伝子の導入効率を上げるために遺伝子を細胞や臓器に運ぶためのベクターの選定が重要です。
ベクターにはウイルスを用いるものと非ウイルス性のものがあり、ウイルスベクターには下記のウイルスが用いられて来ました。
- レトロウイルス
- レンチウイルス
- アデノウイルス
- バキュロウイルス
- ヘルペスウイルス
被導入細胞DNAへの遺伝子導入、遺伝子導入効率、長期の遺伝子発現の点でレンチウイルスが優れていると考えられています。
但し、ウイルスが体の正常な細胞にダメージを与えると本末転倒になりますので、ウイルス自体の自己増殖能を奪うように加工して用います。非ウイルスベクターとしては、プラスミドやリポソームを用いますが、遺伝子導入効率は低いためin vivo遺伝子治療には適さないと考えられています。
遺伝子治療によってがんの再発や転移を抑えられる可能性
遺伝子はヒトだけでなく生き物の体の設計図ですが、DNAが遺伝子の本体であることは20世紀初頭からの多くの研究者のたゆまぬ研究により明らかになりました。
現在では、DNAに書き込まれた遺伝情報がRNAに転写され、さらにRNAの情報が酵素などのタンパク質のアミノ酸配列に翻訳されることにより細胞の生命活動が成り立つことが明らかになっています。
一方、がんは様々な汚染物質による環境の悪化や多量の飲酒や喫煙などの生活習慣により遺伝子の異常が蓄積することにより生ずるため、遺伝子治療によってがんの再発や転移を抑えられるのではないかと考えられます。
がん遺伝子治療が最も効果を発揮する場合
がんは望ましくない環境や生活習慣により遺伝子の異常が蓄積することにより生ずると述べましたが、がんを生ずる遺伝子異常には様々なものがあります。
その中でがん遺伝子治療が最も効果を発揮すると考えられるのは、正常な体の中で日々がんの発生を抑制しているがん抑制遺伝子に異常が生じている場合です。
例えば代表的ながん抑制遺伝子であるp53遺伝子は、正常な細胞内でDNAの修復や細胞増殖サイクルを抑制する機能を持ち、本来細胞ががん化すると自身の細胞を自滅(アポトーシス)させる機能を持っていますが、p53遺伝子に変異や欠失などの異常が生じるとDNAが修復されないまま異常な細胞が増殖しがんが起こると考えられます。
そこで、自己増殖能を奪ったウイルスベクターに正常なp53遺伝子を組み入れてがん細胞に導入し、正常なp53遺伝子をがん細胞のDNAに組み込みp53タンパクを継続的に発現させてやればがん細胞を自滅させることが出来ると考えられます。
がん遺伝子治療の限界
しかし、ここで問題になるのががん細胞の量的な問題です。即ち、がんはCTやMRI等の精密な画像診断でも0.5から1cm以上の大きさにならなければ発見されませんが、細胞の直径は10マイクロメーターくらいですので直径1cmの腫瘍には既に10億個くらいのがん細胞が生じている計算になります。
投与する治療遺伝子は有限ですので大きながんが体に多数存在する場合にはがん遺伝子治療も焼け石に水になります。
がん遺伝子治療と手術、放射線、抗がん剤等の標準治療との併用
従って、がん遺伝子治療は手術、放射線、抗がん剤等の標準治療と組み合わせて行うのが効果的であると考えられます。
即ち、手術や放射線で目に見える大きながんを取り除いたりダメージを与えたりした後(局所治療)で、いずれ再発・転移する可能性がある目に見えないがんを抗がん剤等の全身治療で抑制し、加えてがん遺伝子治療を併用すれば再発・転移を抑制できる可能性が高くなります。
がん遺伝子治療と核酸医薬との併用
今世紀初めにノーベル生理学・医学賞を受賞したRNA干渉という生理現象を応用した核酸医薬と併用することによってもがん遺伝子治療の効果は高まります。
先に細胞の生命活動は、DNAに書き込まれた遺伝情報がRNAに転写され、さらにRNAの情報に基づき酵素などのタンパク質のアミノ酸配列に翻訳されることにより成り立つと述べましたが、詳しくは二本鎖のDNAに書き込まれた遺伝情報を転写するRNAは一本鎖のmRNA(メッセンジャーRNA)と呼ばれる種類のRNAです。
20世紀末の研究によりsiRNAと呼ばれる短い二本鎖のRNAがウイルスや多くの生物に存在することが明らかになり、このsiRNAが相同な配列のmRNAに結合するとそのmRNAを切断し遺伝子発現を抑えてしまうことが明らかになりました。
がんを生ずる遺伝子異常にはがん細胞の増殖を促進するがん遺伝子の過剰発現や機能亢進もあります。このがん遺伝子の発現をRNA干渉法により抑制すればがん細胞の増殖を抑えられるのではないかとの考えから核酸医薬ががんの治療に用いられるようになってきました。核酸医薬においてもウイルスベクターなどを用いてRNAをがん細胞に導入します。
がん遺伝子治療のプレシジョン・メディシン
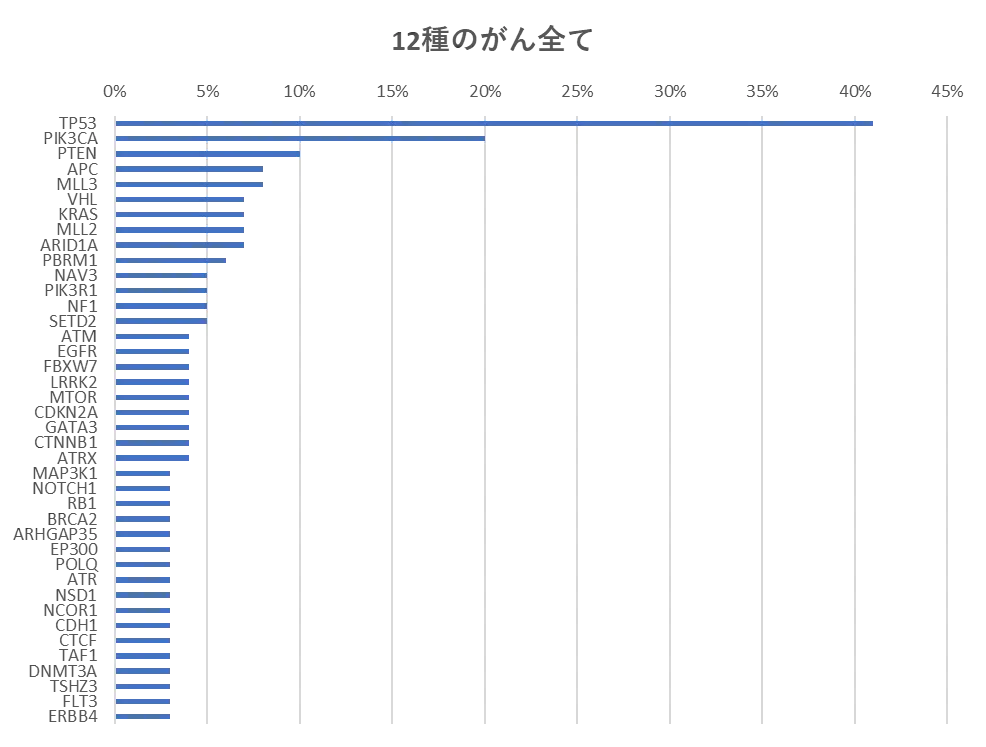
グラフ参考:Katherine A Hoadley et al. Multiplatform analysis of 12 cancer types reveals molecular classification within and across tissues of origin. Cell 2014; 158: 929-944. doi: 10.1016/j.cell.2014.06.049
上のグラフは12種のがん(多形性膠芽腫、頭頸部扁平上皮がん、肺腺がん、肺扁平上皮がん、結腸腺がん、直腸腺がん、腎明細胞がん、膀胱尿路上皮がん、乳房浸潤がん、卵巣漿液性嚢胞腺がん、子宮内膜がん、急性骨髄性白血病)のサンプル(3527)について、特定の遺伝子が変異している比率を調べたものです。なお、TP53はp53、CDKN2Aはp16を示します。
このグラフを見れば半数近くのがんでは代表的ながん抑制遺伝子であるp53遺伝子に変異が生じているのでp53遺伝子を治療用遺伝子として用いれば半数近くのがんの増殖を抑えられるのではないかとも思えます。しかし、腎明細胞がんなどではp53遺伝子にほとんど変異がありません。また遺伝子異常には、遺伝子変異だけでなく、遺伝子コピー数変化、DNAメチル化、マイクロRNA、mRNA発現異常など様々な遺伝子異常があります。
従って、将来的には患者様ごとにどの遺伝子にどのような異常があるのかを調べた上でどのような治療を行なえば良いかを決めることが出来るようになれば、より効果的にがん遺伝子治療を行うことが出来るようになると考えられます。