食道は、口から食べた食べ物を胃に送る働きをする管状の臓器で、部位によって上から頸部食道、胸部食道、腹部食道からなります。食道の壁は内側から外側に向かって粘膜上皮、粘膜固有層、粘膜筋板、粘膜下層、固有筋層、外膜に分かれており、食道の外側にはリンパ節があります。
日本人では、食道がんの約半数は食道の中央付近に発生し、次に食道の下部に発生します。また、食道内に同時に複数発生することもあります。
食道がんは、食道の内面を覆う粘膜の表面から発生しますが、がんが粘膜内に留まるがんを早期食道がん、粘膜下層にまで及ぶがんを表在食道がん、粘膜下層より深い層に及ぶがんを進行食道がんと呼びます。
食道がんの組織型は、日本では90%以上が扁平上皮がんで、欧米に多い腺がんは日本では5%以下です。扁平上皮がんは主に食道の上部から中部に発生することが多いのに対し、腺がんは主に胃食道接合部に近い食道下部に発生することが多いです。
目次
食道がんのリスクファクター
扁平上皮がんでは、飲酒と喫煙が重要な危険因子です。飲酒においては、アルコール脱水素酵素1B(ADH1B)の低活性型、アルデヒド脱水素酵素2(ALDH2)のヘテロ欠損ががんの発生と関係があるとの報告があります。その他には、アカラシア、Plummer-Vinson症候群、肺がんや頭頚部がんの既往、腐食性食道炎、熱い飲食物の摂取習慣が危険因子であると考えられています。
腺がんでは、Barrett食道(胃食道接合部から食道下部にかけて、扁平上皮からなる食道粘膜が円柱上皮からなる胃の粘膜に置換されている状態)、胃食道逆流症(GERD)、肥満、喫煙が危険因子であるとの報告があります。一方、ピロリ菌感染(CagA陽性)はリスクを下げると考えられています。
野菜や果物の摂取、特にβカロテンやビタミンCの摂取は、食道がんの組織型を問わずリスクを下げる予防因子であると報告されています。
食道がんに関係する遺伝子
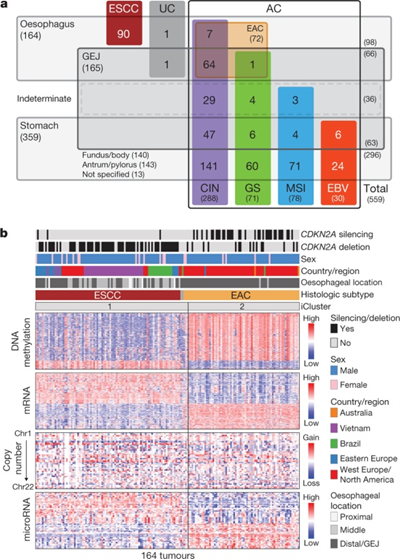
食道がんは、その組織型から扁平上皮がん(ESCC: Esophageal squamous cell carcinoma)と腺がん(EAC: Esophageal adenocarcinoma)に分けられますが、がん細胞の遺伝子の異常に違いがあるのでしょうか。また、食道(Esophagus)、胃食道接合部(GEJ: Gastroesophageal)、胃(Stomach)の腺がん(AC: Adenocarcinoma)にはどのような違いがあるのでしょうか。下図のaは、これらのことを染色体不安定性(CIN: Chromosomal instability)、ゲノム安定性(GS: Genomically stable)、マイクロサテライト不安定性(MSI: Microsatellite instability)、エプスタイン・バール・ウイルス感染性(EBV: Epstein-Barr virus)にどのような違いがあるのかを調べました。
下図のbにおいては、食道の扁平上皮がん(ESCC、茶色)と腺がん(EAC、薄いオレンジ色)で、CDKN2A(p16)遺伝子の発現抑制(CDKN2A silencing、抑制されている場合黒色)、欠損(CDKN2A deletion、欠損している場合黒色)、性別(Sex、男性:青色、女性:ピンク色)、国や地域(Country/region、東ヨーロッパ:青色、西ヨーロッパと北アメリカ:赤色、ベトナム:紫色、ブラジル:緑色、オーストラリア:オレンジ色)、がんの位置(Esophageal location、食道上部:薄い灰色、食道中部:灰色、食道下部と胃食道接合部:濃い灰色)、DNAメチル化(DNA methylation、多い:赤色、少ない:青色)、メッセンジャーRNA発現(mRNA、多い:赤色、少ない:青色)、遺伝子コピー数(Copy number、増幅:赤色、欠損:青色)、マイクロRNA発現(microRNA、多い:赤色、少ない:青色)にどのような違いがあるのかを示しています。
この結果、扁平上皮がんではCDKN2A(p16)遺伝子が欠損していることが多いのに対し腺がんでは発現抑制されていることが多いこと、扁平上皮がんは東ヨーロッパ、ベトナム、ブラジルで多いのに対し腺がんは西ヨーロッパや北アメリカで多いこと、扁平上皮がんは食道上部と食道中部に発生することが多いのに対し腺がんは食道下部や胃食道接続部に発生することが多いこと、扁平上皮がんと腺がんではDNAメチル化、メッセンジャーRNA発現、遺伝子コピー数、マイクロRNA発現にも違いがあることが分かりました。
遺伝子の変異については、食道の扁平上皮がんではTP53(p53)、NFE2L2、MLL2、ZNF750、NOTCH1、TGFBR2が、食道の腺がんではTP53(p53)、CDKN2A(p16)、ARID1A、SMAD4、ERBB2 に有意な変異が見られることが分かりました。
遺伝子の増幅や欠失については、食道の扁平上皮がんではSOX2、TERT、FGFR1、MDM2、NKX2-1に増幅が見られRB1に欠失が見られること、食道の腺がんではVEGFA、ERBB2、GATA6、CCNE1に増幅が見られSMAD4に欠失が見られることが分かりました。
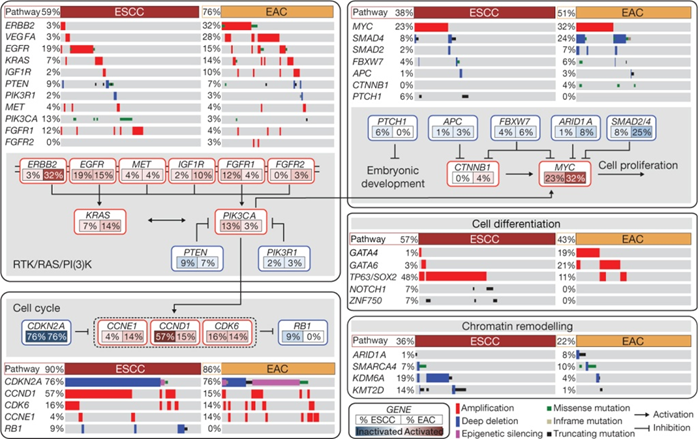
上図では、食道の扁平上皮がん(ESCC、茶色)と腺がん(EAC、薄いオレンジ色)で、RTK/RAS/PI(3)Kシグナリング、細胞分裂周期調節(Cell cycle)、細胞増殖(Cell proliferation)、細胞分化(Cell differentiation)、クロマチンリモデリング(Chromatin remodeling)に関わる遺伝子にどのような変化が生じているかを示しています。
上図左上段に示すRTK/RAS/PI(3)Kシグナリングでは、上側に食道の扁平上皮がん(ESCC、茶色)と腺がん(EAC、薄いオレンジ色)で遺伝子に起こった異常の種類を示しています。赤色は遺伝子の増幅(Amplification)、青色は遺伝子の欠損(Deep deletion)、紫色は遺伝子の発現抑制(Epigenetic silencing)、緑色はタンパク質のアミノ酸が変化する変異(Missense mutation)、灰色はタンパク質のアミノ酸を指令するメッセンジャーRNAの読み枠に変化のない変異(Inframe mutation)、黒色はタンパク質が短くなる変異(Truncating mutation)を示しています。
上図左上段の下側では、RTK/RAS/PI(3)Kシグナリングに関わる遺伝子の相互作用(→:促進、⏊:抑制)を示しています。各遺伝子名の下の左側は扁平上皮がんで変化する割合、右側は腺がんで変化する割合を示し、その変異が遺伝子の働きを活性化する場合は赤色で、不活化する場合は青色で示しています。
扁平上皮がんでは、19%の腫瘍にEGFRを増幅または活性化する変異があり、24%の腫瘍にRTK/RAS/PI(3)Kシグナリングを活性化するPIK3CAまたはPTENまたはPIK3R1の変化が起こっていました。
腺がんでは、RTK/RAS/PI(3)Kシグナリングを活性化するERBB2、KRAS、EGFR、IGF1R、VEGFAの増幅が見られました。ERBB2遺伝子の増幅は、腺がんでは32%の腫瘍に見られましたが、扁平上皮がんでは3%の腫瘍にしか見られませんでした。扁平上皮がんでは、上に示したようにERBB2と結合してRTK/RAS/PI(3)Kシグナリングを活性化するEGFRの変化が19%の腫瘍で見られました。
上図左下段に示す細胞分裂周期調節(Cell cycle)では、扁平上皮がんの76%の腫瘍においてCDKN2A(p16)の不活化、57%の腫瘍においてCCND1の増幅が起こっていました。また、CDK6の増幅、RB1の欠損が見られました。これらの遺伝子の変化は細胞分裂周期を促進する変化です。
腺がんにおいては、15%の腫瘍でCCND1が増幅し、14%の腫瘍でCCNE1が増幅していました。また、76%の腺がんの腫瘍において変異または欠損または発現抑制によるCDKN2Aの不活化が起こっていました。これらの遺伝子の変化も細胞分裂周期を促進する変化です。
上図右上段に示す細胞増殖(Cell proliferation)では、扁平上皮がん、腺がん共にMYCの増幅、SMAD2やSMAD4の欠損など、細胞増殖が促進される変化が起こっていました。
上図右中段に示す細胞分化(Cell differentiation)では、扁平上皮がんにおいてはTP63やSOX2の増幅、腺がんにおいてはGATA4、GATA6、TP63やSOX2の増幅が起こっていました。
上図右下段に示すクロマチンリモデリング(Chromatin remodeling)では、扁平上皮がんにおいてはKDM6A、KMT2D等、腺がんにおいてはARID1A、SMARCA4等に変化が起こっていました。
以上の解析の結果、同じ食道に発生するがんでも扁平上皮がんと腺がんでは遺伝子の変化に大きな違いがあり、どちらにも食道がんと同じ病名を与えることは必ずしも適切ではないことが分かりました。
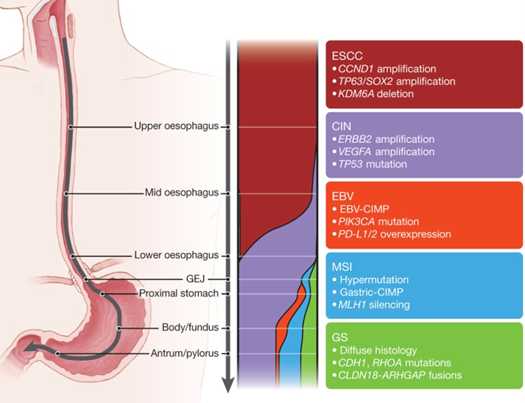
食道の扁平上皮がん(ESCC)では、上図にまとめているようにCCND1やTP63やSOX2の増幅、KDM6Aの欠損に特徴があり、食道の腺がん(EAC)より他の臓器の扁平上皮がんと似ていました。
一方、食道の腺がん(EAC)では、ERBB2やVEGFAの増幅、TP53(p53)の変異、染色体不安定性(CIN)に特徴があり、胃食道接合部や胃がんの染色体不安定(CIN)タイプと相同性が高いことが分かりました。
1.国立がん研究センターがん情報サービス>病名から探す>病名から探す>食道がん
https://ganjoho.jp/public/cancer/esophagus/index.html
2.国立がん研究センター内科レジデント編、がん診療レジデントマニュアル、第8版、医学書院、2019年。
3.The Cancer Genome Atlas Research Network. Integrated genomic characterization of oesophageal carcinoma. Nature 541, 169–175 (2017).
https://www.nature.com/articles/nature20805
参照日:2022年1月28日