胃は、みぞおちの裏あたりにある袋状の器官です。食道につながる胃の入り口を噴門(ふんもん)部、中心部を胃体部、十二指腸につながる胃の出口を幽門(ゆうもん)部と言います。
目次
胃がんとは
胃がんは、胃の内側を覆う粘膜の細胞ががん化し、無秩序に増えて行くことにより生じます。がんは、粘膜から粘膜下層、固有筋層、漿膜下層、漿膜へと浸潤します。がんが漿膜の外側に達すると、近くの大腸や膵臓にも浸潤します。また、がん細胞が血液やリンパ液に入って離れた臓器に転移したり、お腹の中にがん細胞が散らばったりすること(腹腫播種:ふくまくはしゅ)があります。胃がんには、胃の壁を硬くさせながら広がるスキルス胃がんというタイプもあります。
がん細胞を組織型で分類すると、胃がんのほとんどは腺がんです。腺がんは、細胞の形態から分化型と未分化型に分けられます。分化型に対し、未分化型は進行が速い傾向があります。スキルス胃がんには未分化型が多いです。
胃がんのリスクファクター
ヘリコバクター・ピロリ菌への感染、食塩過多、喫煙、野菜・果物の低摂取が胃がんになるリスクを高めると言われています。
胃がんに関係する遺伝子
下の図は、がん組織の切除まで抗がん剤治療や放射線治療を受けていない295人の胃がんの患者様から得た腺がんの組織を用いて遺伝子等の異常を調べた結果です。
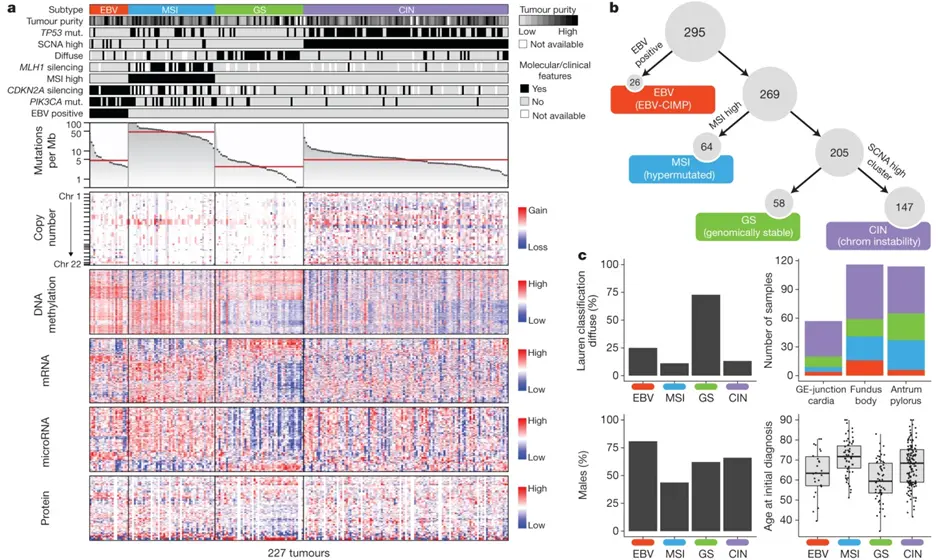
様々な分子生物学的分析から、胃の腺がんは以下の4つのタイプに分けることが出来ました。
- エプスタイン・バール・ウイルス陽性タイプ
(EBV、図ではオレンジ色で示しています) - マイクロサテライト不安定タイプ
(MSI、図では水色で示しています) - 遺伝子の総体であるゲノム安定タイプ
(GS、図では緑色で示しています) - 遺伝子とタンパク質の複合体である染色体不安定タイプ
(CIN、図では紫色で示しています)
①のEBVタイプでは、遺伝子発現を抑制するDNAのメチル化が顕著でした(図aの下から4段目、DNA methylation High)。
②のマイクロサテライトとは、DNAに存在する1から数塩基の単位配列の繰り返し配列です。DNA複製の際に生じる塩基配列の間違いを修復する機能が低下すると、マイクロサテライト配列が腫瘍組織において正常組織と異なる反復回数を示し、その遺伝子から転写翻訳されたタンパク質も不安定になりがんの原因となるのです。マイクロサテライト不安定タイプの腺がんでは、遺伝子の高い変異率が見られました(図aの下から6段目、Mutations per Mb)。また、このタイプの腺がんでは、DNAミスマッチ修復タンパク質の設計図であるMLH1遺伝子に遺伝子発現を抑制するDNAのメチル化が顕著でした(図aの上から6段目、MLH1 silencing)。
③と④のタイプは、①と②のタイプ以外で、遺伝子のコピー数の異常が少ないか(③)顕著か(④)で区別したものです(図aの下から5段目、Copy number)。
胃の腺がんは、細胞の形態から分化型(intestinal type)と未分化型(diffuse type)に分けられますが、未分化型は③のゲノム安定タイプ(GS)に多く見られました(図c左上)。
それぞれのタイプは、噴門部、胃体部、幽門部に見られましたが、噴門部の胃がんでは染色体不安定(CIN)タイプが多く見られたのに対し、胃体部の胃がんではエプスタイン・バール・ウイルス陽性(EBV)タイプが多く見られました(図c右上)。
また、性別としては、エプスタイン・バール・ウイルス陽性(EBV)タイプは男性に多いのに対し、マイクロサテライト不安定(MSI)タイプは女性に多いという結果が得られました(図c左下)。年齢的には、ゲノム安定(GS)タイプは比較的若い年齢で見られたのに対し、マイクロサテライト不安定(MSI)タイプは比較的高い年齢で見られました(図c右下)。
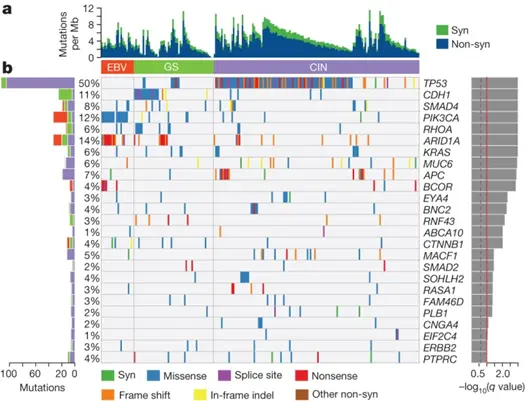
上の図は、胃がん細胞で特異的に変異する遺伝子を知るために、マイクロサテライト不安定タイプ(MSI)など遺伝子変異率が著しいがんを除いた215サンプルについて、どのような遺伝子にどのような変異があるのかを調べたものです。
その結果、25の遺伝子が同定されました。中の四角には、エプスタイン・バール・ウイルス陽性タイプ(EBV、オレンジのバー)、ゲノム安定タイプ(GS、緑色のバー)、染色体不安定タイプ(CIN、紫色のバー)の順で患者様のサンプルを左から右に並べ、どの遺伝子にどのような変異があるかを示しています。最上段のヒストグラムには、タンパク質のアミノ酸配列を変化させない遺伝子変異(Syn、緑)とタンパク質のアミノ酸配列を変化させる遺伝子変異(Non-syn、青)がどれくらいあるかを示しています。どのタイプでもタンパク質のアミノ酸配列を変化させる遺伝子変異が多くあることが分かります。
遺伝子の変異にはいろいろなパターンがあり、色分けして示しています。青色のMissenseとは遺伝子の本体であるDNAの塩基置換によりアミノ酸が変わる変異を示します。メッセンジャーRNAの塩基配列には、タンパク質のアミノ酸配列に翻訳される部分(エクソン)と翻訳されない部分(イントロン)がありますが、メッセンジャーRNAが翻訳される前にはイントロンが取り除かれエクソンが結合する必要があり、この過程をメッセンジャーRNAのスプライシングと言います。
紫色のSplice siteとは、このRNAスプライシングを指示する塩基配列に起こった変異です。
赤色のNonsenseとはタンパク質合成が途中で止まる変異を示します。メッセンジャーRNAの塩基は3つで1種類のアミノ酸を指示し、この3つの塩基の読み枠をコドンと言います。
オレンジ色のFrameshiftとは、コドンを変化させる3の倍数でない塩基の挿入や欠失を言います。
黄色のIn-frame indelとは、コドンを変化させない3の倍数の塩基の挿入や欠失を言います。
染色体不安定タイプ(CIN)では、DNA修復や細胞増殖停止、細胞の自然死であるアポトーシスなど細胞増殖サイクルの抑制を制御するがん抑制遺伝子の一つであるTP53に特に様々な変異が起こっていることが分かります。
遺伝性未分化型胃がんの原因遺伝子として知られており、細胞接着因子の設計図であるCDH1は、ゲノム安定タイプ(GS)で特に多く変異していることも分かります。エプスタイン・バール・ウイルス陽性タイプ(EBV)では、PIK3CAやARID1A遺伝子に特に多くの変異が見られました。
胃がんに対する分子標的薬
ハーツ―(HER2、ERBB2)は、細胞増殖を促進させる細胞膜貫通受容体ですが、胃がんの4.4%から53.4%で高い発現が見られます。また、組織学的には未分化型胃がんより分化型胃がんで発現が高いと言われています。
トラスツズマブ(商品名ハーセプチン)は、ハーツ―を標的とした分子標的薬で、2011年にHER2過剰発現が確認された治癒切除不能な進行・再発胃がんに対する治療薬として承認されました。
HER2過剰発現は、HER2分子の局在を可視化する免疫組織化学染色により3+の判定、または2+の判定かつHER2タンパク質に翻訳されるHER2遺伝子から転写されたメッセンジャーRNAの局在を可視化するインサイチューハイブリダイゼイション染色で陽性の場合にHER2の過剰発現ありとされます。
1.国立がん研究センター がん情報サービス>それぞれのがんの解説>胃がんhttps://ganjoho.jp/public/cancer/stomach/index.html
2.国立がん研究センター内科レジデント編、がん診療レジデントマニュアル、第8版、医学書院、2019年。
3.Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014; 513: 202-9. doi: 10.1038/nature13480. https://www.nature.com/articles/nature13480
4.秋山好光、湯浅保仁「胃がん」、がん生物学イラストレイテッド、第2版、羊土社、2019年、pp. 455-465。
5.橋本至、石川俊平「胃がんのゲノム解析と治療標的」、がんゲノム医療―網羅的解析からの知見と臨床応用の展望、医学のあゆみ、医歯薬出版株式会社、2020年、pp. 468-475。
参照:2021年06月28日